热门话题
#
Bonk 生态迷因币展现强韧势头
#
有消息称 Pump.fun 计划 40 亿估值发币,引发市场猜测
#
Solana 新代币发射平台 Boop.Fun 风头正劲

DailyHealthcareAI
分享有关人工智能在放射学、病理学、遗传学、蛋白质设计等领域的应用的研究论文和新闻。让我们一起学习吧!
🚀大卫·贝克来自@UWproteindesign的预印本 👇👇
是什么让切割蛋白质键如此具有挑战性,以至于自然进化出具有金属辅因子的专门酶来完成这一任务?@biorxivpreprint @ETH_en
"半胱氨酸蛋白酶的计算设计"
• 在生理条件下,蛋白质中的酰胺键的半衰期长达数百年,使其比酯键更稳定(氨基离去基团的pKa >35,而活化酯的pKa <8),而之前的计算酶设计仅在活化的小分子酯底物上取得成功,而不是需要能量密集的肽键断裂,这对于蛋白酶来说是必需的。
• 研究人员使用RoseTTAFold Diffusion 2 for Molecular Interfaces (RFD2-MI)从最小催化基元设计锌蛋白酶,构建了一个理想的活性位点,包含五个功能基团(三个锌结合残基H1、H2、E1,一个催化碱E2和一个稳定负离子的酪氨酸Y),基于氨肽酶N和阿斯塔辛的结构,进行双面设计以确保目标酰胺键的精确定位。
• 在135个设计中,36%显示出活性(仅锌模型为14.7%,锌-水模型为87.5%),所有活性设计在质谱确认的预定位点精确切割;最活跃的设计(Zn45切割ZnO36底物)达到了0.025 ± 0.002 s⁻¹的kcat,26 ± 5 μM的KM,以及900 ± 200 M⁻¹s⁻¹的kcat/KM,代表着比未催化水解快超过10⁸倍;设计表现出锌结合,Kd在10⁻¹⁰到10⁻⁸ M之间,在5个支架中的4个显示底物特异性,并且可以重新编程以切割与疾病相关的人类TDP-43蛋白,4个变体在5小时内实现≥80%的切割。
作者:Hojae Choi等,Donald Hilvert,Samuel J. Pellock,大卫·贝克
链接:

605
语言模型能否在没有明确结构训练数据的情况下学习RNA结构?@NatureComms @Tsinghua_Uni
"ERNIE-RNA:一种具有结构增强表示的RNA语言模型"
• 现有的RNA语言模型忽视了序列中的结构信息,导致特征提取不完整和性能不佳,尽管RNA具有层次结构,初级序列折叠成特定的结构构象,从而决定生物功能。传统的RNA结构预测计算方法面临独特的挑战:基于热力学的方法受限于参数准确性,基于比对的方法在缺乏足够同源序列时难以发挥作用,而深度学习模型在未见过的RNA家族上表现出有限的泛化能力。虽然像RNA-FM(训练于2300万序列)、UNI-RNA(10亿序列,4亿参数)和RiNALMo(3600万序列,6.5亿参数)这样的BERT风格RNA语言模型已经出现,但它们未能充分整合结构信息,其中一些如UTR-LM试图通过整合来自RNAfold的预测结构来解决这一问题,但面临预测错误和泛化能力降低的限制。
• ERNIE-RNA是一个具有8600万参数的RNA预训练语言模型,基于修改后的BERT架构,具有12个变换器块和12个注意力头,训练于2040万非编码RNA序列,这些序列来自RNAcentral,经过过滤长度超过1022个核苷酸的序列,并在100%相似度下应用CD-HIT冗余去除。该模型结合了基于碱基配对的注意力偏置机制,在全对全的配对位置矩阵中为AU对分配值2,为CG对分配值3,为GU对分配可调参数α(初始值为0.8),替代了第一个变换器层中的偏置项。预训练使用掩蔽语言建模,随机替换15%的标记,使用24个32G-V100 GPU训练20天,使用fairseq,基础学习率为0.0001,20000个预热步骤和0.01的权重衰减,生成注意力图(L×L×156)和标记嵌入(12×768×L)作为输出。
• ERNIE-RNA的注意力图展示了零样本RNA二级结构预测能力,在bpRNA-1m测试集上的中位F1分数为0.552,超越了RNAfold(0.492)、RNAstructure(0.491)、RNAErnie(0.440)和RNA-BERT(0.365),且无需微调。经过微调后,ERNIE-RNA在bpRNA-1m上达到了最先进的宏平均F1分数0.873,超越了RiNALMo(0.850,6.5亿参数)和UNI-RNA(0.821,4亿参数),在ArchiveII(0.954对RiNALMo的0.892)和RIVAS TestSetB(0.721对RiNALMo的0.555)上也表现出类似的领先。在具有挑战性的跨家族泛化测试中,ERNIE-RNA冻结模型在bpRNA-new上达到了0.646的F1分数,在RNA3DB-2D上达到了0.590,超越了传统的动态规划方法如Eternafold(0.639),并在所有深度学习竞争者中保持优势。ERNIE-RNA在各种下游任务中也表现出色:RNA接触图预测的Top-L/1精度为0.68(对比RNAcontact的集成为0.46),5'UTR MRL预测在随机测试集上的R²为0.92,在人类测试集上的R²为0.86,RNA-蛋白结合预测超越所有测试方法,ncRNA家族分类准确率为0.9844(0%边界噪声)和0.9820(200%边界噪声),剪接位点预测F1分数在四个物种间范围为0.9180到0.9612,SpliceAI数据集的top-K准确率为55.37%(对比RNA-FM的34.84%),替代多腺苷酸化预测的R²为78.39%(对比RNA-FM的70.32%)。
作者:Weijie Yin, Zhaoyu Zhang, Shuo Zhang, Liang He等,Xuegong Zhang, Tao Qin & Zhen Xie
链接:

629
人工智能能否通过模仿自然蛋白质与疾病靶点结合的方式来设计治疗性肽?@Tsinghua_Uni @natBME
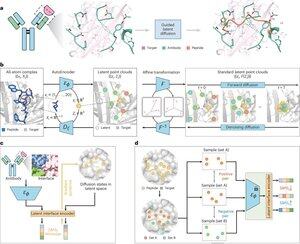
"通过结合界面模仿进行肽设计,使用PepMimic"
• 研究人员开发了PepMimic,这是一种结合了全原子自编码器、潜在扩散模型和界面编码器的AI算法,用于设计模仿靶蛋白与已知结合物(如抗体或受体)之间结合界面的肽(4-25个氨基酸),解决了当前肽设计中需要手动专业知识且难以处理不连续结合表面的问题。
• 超过80种肽类治疗药物已获批用于包括糖尿病和癌症在内的疾病,提供了高特异性、低毒性和潜在口服给药等优势,相较于小分子和生物制剂,然而,传统上设计蛋白质-蛋白质相互作用的肽模仿物需要广泛的专业知识,并且无法有效处理不连续结合界面,而现有的AI模型则侧重于先处理骨架再处理序列的方法,而不是捕捉关键的侧链几何形状以实现准确的氨基酸相互作用。
• PepMimic在4,157个蛋白质-肽复合物和来自蛋白质数据银行的70,645个肽样片段上进行了训练,使用自编码器将全原子几何映射到潜在空间,采用扩散模型进行100次去噪步骤,并通过对比学习训练一个界面编码器,该编码器通过最小化设计界面与参考界面在潜在空间中的距离来指导生成,候选肽使用Rosetta界面能量、FoldX能量、界面命中指标和AlphaFold Multimer pLDDT分数进行排名,然后选择前肽(384个针对已知结合物的靶点,94-290个针对AI生成的结合物)进行表面等离子体共振成像实验。
• PepMimic在93个测试复合物的31个任务中实现了0.71的平均AUROC(优于RFDiffusion的0.69),为5个药物靶点(PD-L1、CD38、BCMA、HER2、CD4)设计了384个肽,其中8%实现了KD < 100 nM,26个肽在10⁻⁹ M水平上达到KD(远高于随机库筛选),生成了模仿AI设计结合物的CD38和TROP2肽,成功率为14%(CD38为16%,TROP2为8%),并在小鼠模型中展示了有效的体内肿瘤靶向,所选肽在PD-L1阳性肿瘤中的摄取量提高了8.85倍,在TROP2阳性肿瘤中的摄取量提高了16.18倍,成功率比实验随机库筛选高出20,000-90,000倍。
作者:Xiangzhe Kong等,Zihua Wang,Yang Liu & @musicsuperman
链接:
1.24K
热门
排行
收藏












