Trendaavat aiheet
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
Tutkimuspapereiden ja uutisten jakaminen tekoälysovelluksista radiologiassa, patologiassa, genetiikassa, proteiinisuunnittelussa ja monissa muissa. Opitaan yhdessä!
🚀David Bakerin esipainos vuodelta @UWproteindesign 👇👇
Mikä tekee proteiinisidosten katkaisemisesta niin haastavaa, että luonto kehitti erikoistuneita entsyymejä metallikofaktoreilla sen saavuttamiseksi?@biorxivpreprint @ETH_en
"Kysteiiniproteaasien laskennallinen suunnittelu"
• Proteiinien amidisidoksilla on puoliintumisaika satoja vuosia fysiologisissa olosuhteissa, mikä tekee niistä huomattavasti stabiilimmat kuin esterisidosten (amiiniryhmät, joilla on pKa >35 verrattuna <8 aktivoituihin estereihin), ja aiempi laskennallinen entsyymisuunnittelu on onnistunut vain aktivoiduilla pienimolekyyliesterialustoilla, ei proteaasien energiaa vaativalla peptidisidosten pilkkomisella.
• Tutkijat käyttivät RoseTTAFold Diffusion 2 for Molecular Interfaces (RFD2-MI) -menetelmää suunnitellakseen sinkkiproteaaseja minimaalisista katalyyttisistä motiiveista, rakentaen ihanteellisen aktiivisen kohteen, jossa oli viisi toiminnallista ryhmää (kolme sinkkiä sitovaa jäämää H1, H2, E1, yksi katalyyttinen emäs E2 ja yksi oksianionia stabiloiva tyrosiini-Y) aminopeptidaasi N- ja astasiinirakenteiden pohjalta, suorittaen kaksipuolisen suunnittelun sekä proteaasin että substraattisekvenssin varmistaakseen kohdeamidisidoksen tarkan sijainnin.
• 135 mallista, jotka testattiin yhdellä suunnittelukierroksella, 36 % osoitti aktiivisuutta (14,7 % pelkästään zn-malleissa ja 87,5 % zn-vesimalleissa), ja kaikki aktiiviset mallit halkaistiin tarkasti tarkoitetuilla paikoilla, jotka vahvistettiin massaspektrometrialla; aktiivisin rakenne (Zn45 halkaisemassa ZnO36-alustaa) saavutti kcat 0,025 ± 0,002 s⁻¹, KM 26 ± 5 μM, ja kcat/KM 900 ± 200 M⁻¹s⁻¹, mikä edustaa >10⁸-kertaista kiihtyvyyttä katalysoimattoman hydrolyysin yli; mallit osoittivat sinkin sitoutumista Kd:hen välillä 10⁻¹⁰ ja 10⁻⁸ M, osoittivat substraattispesifisyyttä neljässä viidestä tukirakenteesta ja voitiin ohjelmoida uudelleen leikkaamaan tautiin vaikuttavaa ihmisen TDP-43-proteiinia neljällä variantilla, jotka saavuttivat ≥80 % pilkkoutumisen viidessä tunnissa.
Kirjoittajat: Hojae Choi ym. al Donald Hilvert, Samuel J. Pellock, David Baker
Linkki:

693
Voiko kielimalli oppia RNA:n rakenteen ilman eksplisiittistä rakenteellista koulutusdataa?@NatureComms @Tsinghua_Uni
"ERNIE-RNA: RNA-kielimalli, jossa on rakennetta parannetut esitykset"
• Olemassa olevat RNA-kielimallit jättävät rakenteellisen tiedon huomiotta sekvensseissä, mikä johtaa epätäydelliseen ominaisuuksien poimimiseen ja heikkoon suorituskykyyn, vaikka RNA:n hierarkkinen järjestys on, jossa primaarisekvenssit taittuvat tiettyihin rakenteellisiin konformaatioihin, jotka määrittävät biologiset toiminnot. Perinteiset laskennalliset lähestymistavat RNA-rakenteen ennustamiseen kohtaavat selkeitä haasteita: termodynamiikkaan perustuvat menetelmät ovat parametrien tarkkuuden rajoittamia, kohdistukseen perustuvat menetelmät kamppailevat ilman riittäviä homologisia sekvenssejä ja syväoppimismallit yleistävät rajoittuneesti näkymättömiin RNA-perheisiin. Vaikka BERT-tyyliset RNA-kielimallit, kuten RNA-FM (koulutettu 23 miljoonalla sekvenssillä), UNI-RNA (1 miljardi sekvenssi, 400M parametria) ja RiNALMo (36M sekvenssi, 650M parametria) ovat syntyneet, ne eivät pysty riittävästi sisällyttämään rakenteellista tietoa, ja jotkut, kuten UTR-LM, pyrkivät ratkaisemaan tämän ottamalla mukaan ennustettuja rakenteita RNAfoldista, mutta kohtaavat rajoituksia ennustevirheiden ja heikentyneen yleistyksen vuoksi.
• ERNIE-RNA on 86 miljoonan parametrin RNA-esikoulutettu kielimalli, joka perustuu muokattuun BERT-arkkitehtuuriin, jossa on 12 muuntajalohkoa ja 12 huomion päätettä, ja joka on koulutettu 20,4 miljoonaan ei-koodaavaan RNA-sekvenssiin RNAcentralista suodattamalla sekvenssejä, jotka ovat pidempiä kuin 1022 nukleotidia ja soveltaen CD-HIT-redundanssin poistoa 100 % samankaltaisuudella. Mallissa on perusparien pohjalta ohjattu tarkkaavaisuusharhamekanismi, joka antaa arvot 2 AU-pareille, 3 CG-pareille ja säädettävä parametri α (aluksi 0,8) GU-pareille all-vastaan-all -parin sijaintimatriisissa, korvaten bias-termin ensimmäisessä muuntajakerroksessa. Esikoulutus käytti maskattua kielimallinnusta, jossa 15 % tokeneista vaihdettiin satunnaisesti, ja koulutettiin 20 päivää 24 32G-V100 GPU:lla käyttäen fairseq'ta perusoppimisnopeudella 0,0001, 20 000 lämmittelyaskelta ja 0,01 painon heikkenemistä, tuottaen sekä huomiokarttoja (L×L×156) että token-upotuksia (12×768×L) ulostuloina.
• ERNIE-RNA:n tarkkaavaisuuskartat osoittivat nollashotin RNA:n sekundaarirakenteen ennustamiskyvyn mediaanipisteellä 0,552 bpRNA-1m-testisarjassa, mikä päihitti RNAfoldin (0,492), RNA-rakenteen (0,491), RNAErnien (0,440) ja RNA-BERTin (0,365) ilman hienosäätöä. Hienosäädön jälkeen ERNIE-RNA saavutti huippumodernit makrokeskiarvoiset F1-pisteet 0,873 bpRNA-1m:llä, ohittaen RiNALMon (0,850, 650M parametrit) ja UNI-RNA:n (0,821, 400M parametrit), vastaavalla johtajuudella ArchiveII:ssa (0,954 vs RiNALMo:n 0,892) ja RIVAS TestSetB:ssä (0,721 vs RiNALMo:n 0,555). Haastavien perheiden välisissä yleistystesteissä ERNIE-RNA saavutti F1-pisteet 0,646 bpRNA-new:ssa ja 0,590 RNA3DB-2D:ssä, päihittäen perinteiset dynaamisen ohjelmoinnin menetelmät kuten Eternafold (0,639) ja säilyttäen ylivoimansa kaikkiin syväoppimiskilpailijoihin nähden. ERNIE-RNA saavutti myös erinomaisen suorituskyvyn erilaisissa jälkivaiheen tehtävissä: RNA-kontaktikartan ennustaminen Top-L/1-tarkkuudella 0,68 (verrattuna RNAcontactin kokonaisuuteen 0,46), 5'UTR MRL-ennuste R²:llä 0,92 satunnaistestisarjalla ja 0,86 ihmisen testisarjalla, RNA-proteiinien sitoutumisen ennustaminen ylitti kaikki testatut menetelmät, ncRNA-perheen luokittelutarkkuus 0,9844 (0 % rajakohina) ja 0,9820 (200 % rajakohina), splice-paikan ennusteen F1-pisteet vaihtelevat 0,9180–0,9612 neljän lajin välillä, huippu-K-tarkkuus 55,37 % SpliceAI-aineistossa (verrattuna RNA-FM:iin 34,84 %) ja vaihtoehtoisen polyadenyloinnin ennusteen R² 78,39 % (vs RNA-FM:n 70,32 %).
Kirjoittajat: Weijie Yin, Zhaoyu Zhang, Shuo Zhang, Liang He ym. al Xuegong Zhang, Tao Qin ja Zhen Xie
Linkki:

696
Voiko tekoäly suunnitella terapeuttisia peptidejä jäljittelemällä sitä, miten luonnolliset proteiinit sitoutuvat sairauden kohteisiin@Tsinghua_Uni @natBME
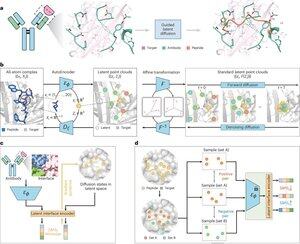
"Peptidisuunnittelu sitoutumisrajapinnan matkimisen kautta PepMimicin kanssa"
• Tutkijat kehittivät PepMimicin, tekoälyalgoritmin, joka yhdistää koko atomin autokooderin, piilevän diffuusiomallin ja rajapintakooderin suunnitellakseen peptidejä (4-25 aminohappoa), jotka jäljittelevät sitoutumisrajapintoja kohdeproteiinien ja tunnettujen sideaineiden, kuten vasta-aineiden tai reseptorien, välillä, mikä puuttuu nykyisen peptidisuunnittelun rajoituksiin, jotka vaativat manuaalista asiantuntemusta ja kamppailevat epäjatkuvien sitoutumispintojen kanssa.
• Yli 80 peptiditerapiaa on hyväksytty sairauksiin, kuten diabetekseen ja syöpään, ja ne tarjoavat etuja, kuten korkean spesifisyyden, pienemmän toksisuuden ja mahdollisen suun kautta annettavan annoksen verrattuna pieniin molekyyleihin ja biologisiin lääkkeisiin, mutta proteiini-proteiini-vuorovaikutusten peptidijäljitelmien suunnittelu vaatii perinteisesti laajaa asiantuntemusta eikä pysty käsittelemään tehokkaasti epäjatkuvia sitoutumisrajapintoja, kun taas nykyiset tekoälymallit keskittyvät runkoverkko-sitten-sekvenssi-lähestymistapoihin sen sijaan, että ne kaappaisivat ratkaisevan sivuketjun geometria tarkkoja aminohappovuorovaikutuksia varten.
• PepMimic koulutettiin 4 157 proteiini-peptidikompleksilla ja 70 645 peptidin kaltaisella fragmentilla Protein Data Bankista käyttämällä autoenkooderia kaikkien atomien geometrioiden kartoittamiseen piilevään avaruuteen, diffuusiomallia 100 kohinanpoistovaiheelle ja kontrastiivista oppimista rajapintakooderin kouluttamiseksi, joka ohjaa sukupolvia minimoimalla suunniteltujen ja referenssirajapintojen väliset etäisyydet piilevässä avaruudessa, ehdokkaat luokiteltiin Rosetta-rajapintaenergian avulla, FoldX-energia, rajapinnan osumamittarit ja AlphaFold Multimer pLDDT -pisteet ennen parhaiden peptidien valitsemista (384 kohteille, joissa on tunnettuja sideaineita, 94-290 tekoälyn luomille sideaineille) pintaplasmoniresonanssikuvauskokeisiin.
• PepMimic saavutti keskimääräisen AUROC-arvon 0,71 31 tehtävässä 93 testikompleksilla (parempi kuin RFDiffusionin 0,69), suunnitteli 384 peptidiä 5 lääkekohteelle (PD-L1, CD38, BCMA, HER2, CD4), joista 8 % saavutti KD < 100 nM:n ja 26 peptidiä, jotka saavuttivat KD:n 10⁻⁹ M-tasolla (huomattavasti korkeampi kuin satunnainen kirjastoseulonta), tuotti peptidejä, jotka jäljittelivät tekoälyn suunnittelemia sideaineita CD38:lle ja TROP2:lle 14 %:n onnistumisprosentilla (16 % CD38:lle, 8 % TROP2:lle) ja osoitti tehokkaan in vivo -kasvaimen kohdistamisen hiirimalleissa, joissa valitut peptidit osoittivat 8,85 kertaa suurempaa imeytymistä PD-L1-positiivisissa kasvaimissa ja 16,18 kertaa suurempaa sisäänottoa TROP2-positiivisissa kasvaimissa, jolloin onnistumisprosentit olivat 20 000-90 000 kertaa korkeammat kuin kokeellinen satunnaiskirjastoseulonta.
Tekijät: Xiangzhe Kong et. al Zihua Wang, Yang Liu & @musicsuperman
Linkki:
1,3K
Johtavat
Rankkaus
Suosikit












