Tópicos em alta
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
Compartilhando trabalhos de pesquisa e notícias sobre aplicações de IA em radiologia, patologia, genética, design de proteínas e muito mais. Vamos aprender juntos!
🚀Pré-print de David Baker da @UWproteindesign 👇👇
O que torna o corte de ligações proteicas tão desafiador a ponto de a natureza evoluir enzimas especializadas com cofatores metálicos para isso? @biorxivpreprint @ETH_en
"Projeto computacional de proteases de cisteína"
• As ligações amida em proteínas têm meias-vidas de centenas de anos sob condições fisiológicas, tornando-as muito mais estáveis do que as ligações éster (com grupos amina deixando grupos tendo pKa >35 contra <8 para ésteres ativados), e o design enzimático computacional anterior só teve sucesso com substratos de éster de pequenas moléculas ativadas, em vez da clivagem energéticamente exigente das ligações peptídicas necessárias para proteases.
• Os pesquisadores usaram a RoseTTAFold Diffusion 2 for Molecular Interfaces (RFD2-MI) para projetar proteases de zinco a partir de motivos catalíticos mínimos, construindo um sítio ativo ideal com cinco grupos funcionais (três resíduos de ligação ao zinco H1, H2, E1, uma base catalítica E2 e uma tirosina estabilizadora oxianionista Y) baseados em estruturas de aminopeptidase N e astacina, realizando design bilateral tanto de sequências de protease quanto de substrato para garantir o posicionamento preciso da ligação amida alvo.
• Dos 135 projetos testados em uma única rodada, 36% apresentaram atividade (14,7% para modelos apenas com Zn e 87,5% para modelos com Zn e água), com todos os projetos ativos cortando precisamente nos locais pretendidos confirmados por espectrometria de massa; o projeto mais ativo (substrato Zn45 de Cescido ZnO36) alcançou kcat de 0,025 ± 0,002 s⁻¹, KM de 26 ± 5 μM e kcat/KM de 900 ± 200 M⁻¹s⁻¹, representando >aceleração de taxa 10⁸ vezes maior que a hidrólise não catalisada; os desenhos apresentaram ligação de zinco com Kd entre 10⁻¹⁰ e 10⁻⁸ M, mostraram especificidade de substrato em 4 dos 5 andaimes e puderam ser reprogramados para clivar a proteína TDP-43 humana relevante para a doença, com 4 variantes alcançando ≥80% de clivagem em 5 horas.
Autores: Hojae Choi et. al Donald Hilvert, Samuel J. Pellock, David Baker
Link:

618
Um modelo de linguagem pode aprender a estrutura de RNA sem dados explícitos de treinamento estrutural?@NatureComms @Tsinghua_Uni
"ERNIE-RNA: um modelo de linguagem de RNA com representações aprimoradas por estrutura"
• Modelos existentes de linguagem de RNA negligenciam informações estruturais em sequências, levando à extração incompleta de características e desempenho subótimo, apesar da organização hierárquica do RNA, onde as sequências primárias se dobram em conformações estruturais específicas que determinam funções biológicas. Abordagens computacionais tradicionais para previsão de estruturas de RNA enfrentam desafios distintos: métodos baseados em termodinâmica são limitados pela precisão dos parâmetros, métodos baseados em alinhamento têm dificuldade sem sequências homólogas suficientes, e modelos de aprendizado profundo apresentam generalização limitada para famílias de RNA não vistas. Embora modelos de linguagem de RNA no estilo BERT como RNA-FM (treinado com 23 milhões de sequências), UNI-RNA (1 bilhão de sequências, 400M parâmetros) e RiNALMo (36M sequências, 650M parâmetros) tenham surgido, eles não incorporam adequadamente informações estruturais, com alguns, como o UTR-LM, tentando resolver isso incorporando estruturas previstas a partir do RNAfold, mas enfrentando limitações devido a erros de predição e redução da capacidade de generalização.
• ERNIE-RNA é um modelo de linguagem pré-treinado de RNA com 86 milhões de parâmetros baseado em arquitetura BERT modificada, com 12 blocos transformadores e 12 cabeças de atenção, treinado em 20,4 milhões de sequências de RNA não codificantes do RNAcentral após filtrar sequências maiores que 1022 nucleotídeos e aplicar remoção de redundância CD-HIT com 100% de similaridade. O modelo incorpora um mecanismo de viés de atenção informado por pareamento de base que atribui valores de 2 para pares AU, 3 para pares CG e um parâmetro ajustável α (inicialmente 0,8) para pares GU em uma matriz de posição par-à-pare, substituindo o termo de viés na primeira camada transformadora. O pré-treinamento usou modelagem de linguagem mascarada com 15% dos tokens substituídos aleatoriamente, treinado por 20 dias em 24 GPUs 32G-V100 usando fairseq com taxa base de aprendizado 0,0001, 20.000 passos de aquecimento e decaimento de peso de 0,01, gerando tanto mapas de atenção (L×L×156) quanto embeddings de tokens (12×768×L) como saídas.
• Os mapas de atenção do ERNIE-RNA demonstraram capacidade de predição de estrutura secundária de RNA zero-shot com escore mediano F1 de 0,552 no conjunto de teste bpRNA-1m, superando RNAfold (0,492), RNAstructure (0,491), RNAErnie (0,440) e RNA-BERT (0,365) sem ajuste fino. Após ajustes finos, o ERNIE-RNA alcançou escores F1 macro-médios de última geração de 0,873 no bpRNA-1m, superando o RiNALMo (0,850, 650M) e o UNI-RNA (0,821, 400M parâmetros), com liderança semelhante no ArchiveII (0,954 contra 0,892 do RiNALMo) e no RIVAS TestSetB (0,721 contra 0,555 do RiNALMo). Em testes desafiadores de generalização entre famílias, o ERNIE-RNA congelado alcançou escores F1 de 0,646 em bpRNA-novo e 0,590 em RNA3DB-2D, superando métodos tradicionais de programação dinâmica como Eternafold (0,639) e mantendo superioridade sobre todos os concorrentes de deep learning. ERNIE-RNA também alcançou desempenho superior em diversas tarefas a jusante: predição do mapa de contato de RNA com precisão Top-L/1 de 0,68 (contra o conjunto do RNAcontact em 0,46), predição de MRL 5'UTR com R² de 0,92 em conjunto de teste aleatório e 0,86 em conjunto de teste humano, previsão de ligação RNA-proteína superando todos os métodos testados, precisão de classificação da família de ncRNAs de 0,9844 (0% ruído de fronteira) e 0,9820 (200% ruído de fronteira), Previsão do sítio de emenda - escores F1 variando de 0,9180 a 0,9612 em quatro espécies, precisão top-K de 55,37% no conjunto de dados SpliceAI (vs 34,84 do RNA-FM) e predição alternativa de poliadenilação R² de 78,39% (vs 70,32% do RNA-FM).
Autores: Weijie Yin, Zhaoyu Zhang, Shuo Zhang, Liang He, etc. al Xuegong Zhang, Tao Qin & Zhen Xie
Link:

643
A inteligência artificial pode projetar peptídeos terapêuticos imitando como as proteínas naturais se ligam a alvos de doenças?@Tsinghua_Uni @natBME
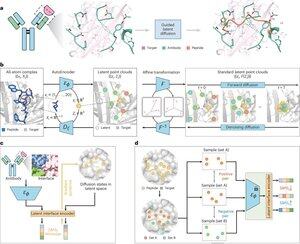
"Design de peptídeos por meio de mimetismo de interface de ligação com PepMimic"
• Os pesquisadores desenvolveram o PepMimic, um algoritmo de IA que combina um autocodificador de todos os átomos, modelo de difusão latente e codificador de interface para projetar peptídeos (4-25 aminoácidos) que imitam interfaces de ligação entre proteínas-alvo e ligantes conhecidos, como anticorpos ou receptores, abordando as limitações no design atual de peptídeos que requer experiência manual e luta com superfícies de ligação descontínuas.
• Mais de 80 terapias peptídicas são aprovadas para doenças como diabetes e câncer, oferecendo vantagens como alta especificidade, menor toxicidade e potencial administração oral em comparação com pequenas moléculas e produtos biológicos, mas projetar imitadores de peptídeos de interações proteína-proteína tradicionalmente requer ampla experiência e não pode lidar efetivamente com interfaces de ligação descontínuas, enquanto os modelos de IA existentes se concentram em abordagens de backbone e sequência, em vez de capturar a cadeia lateral crucial geometria para interações precisas de aminoácidos.
• O PepMimic foi treinado em 4.157 complexos proteína-peptídeo e 70.645 fragmentos semelhantes a peptídeos do Protein Data Bank, usando um autoencoder para mapear geometrias de todos os átomos para o espaço latente, um modelo de difusão para 100 etapas de redução de ruído e aprendizado contrastivo para treinar um codificador de interface que orienta a geração minimizando as distâncias entre as interfaces projetadas e de referência no espaço latente, com candidatos classificados usando a energia da interface Rosetta, Energia FoldX, métricas de acerto de interface e pontuações de pLDDT do AlphaFold Multimer antes de selecionar os principais peptídeos (384 para alvos com ligantes conhecidos, 94-290 para ligantes gerados por IA) para experimentos de ressonância plasmônica de superfície.
• O PepMimic alcançou AUROC médio de 0,71 em 31 tarefas em 93 complexos de teste (superando os 0,69 do RFDiffusion), projetou 384 peptídeos para 5 alvos de drogas (PD-L1, CD38, BCMA, HER2, CD4) com 8% atingindo KD < 100 nM e 26 peptídeos atingindo KD no nível de 10⁻⁹ M (substancialmente mais alto do que a triagem aleatória da biblioteca), gerou peptídeos imitando aglutinantes projetados por IA para CD38 e TROP2 com taxa de sucesso de 14% (16% para CD38, 8% para TROP2) e demonstrou direcionamento tumoral in vivo eficaz em modelos de camundongos com peptídeos selecionados mostrando captação 8,85 vezes maior em tumores positivos para PD-L1 e captação 16,18 vezes maior em tumores positivos para TROP2, alcançando taxas de sucesso 20.000-90.000 vezes maiores do que a triagem experimental de biblioteca aleatória.
Autores: Xiangzhe Kong et. al Zihua Wang, Yang Liu & @musicsuperman
Link:
1,25K
Melhores
Classificação
Favoritos












