Temas en tendencia
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
Compartir trabajos de investigación y noticias sobre aplicaciones de IA en radiología, patología, genética, diseño de proteínas y muchos más. ¡Aprendamos juntos!
🚀Preprint de David Baker de @UWproteindesign 👇👇
¿Qué hace que cortar enlaces proteicos sea tan complicado como para que la naturaleza haya desarrollado enzimas especializadas con cofactores metálicos para lograrlo@biorxivpreprint @ETH_en?
"Diseño computacional de proteasas de cisteína"
• Los enlaces amida en proteínas tienen vidas medias de cientos de años bajo condiciones fisiológicas, lo que los hace mucho más estables que los enlaces éster (con grupos salientes aminas teniendo pKa >35 frente a <8 para ésteres activados), y el diseño enzimático computacional previo solo ha tenido éxito con sustratos ésteres de molécula pequeña activados en lugar de la exigente escisión energética de enlaces peptídicos necesaria para las proteasas.
• Los investigadores utilizaron RoseTTAFold Diffusion 2 para Interfaces Moleculares (RFD2-MI) para diseñar proteasas de zinc a partir de motivos catalíticos mínimos, construyendo un sitio activo ideal con cinco grupos funcionales (tres residuos de unión al zinc H1, H2, E1, una base catalítica E2 y una tirosina estabilizadora oxianión) basados en estructuras de aminopeptidasa N y astacina, realizando un diseño bilateral tanto de secuencias de proteasas como de sustrato para asegurar una posición precisa del enlace amida objetivo.
• De 135 diseños probados en una sola ronda de diseño, el 36% mostró actividad (14,7% para modelos solo con Zn y 87,5% para modelos con Zn-agua), con todos los diseños activos que se cortaron con precisión en los lugares previstos confirmados por espectrometría de masas; el diseño más activo (sustrato de ZnO36 que corta ZnO36) logró kcat de 0,025 ± 0,002 s⁻¹, KM de 26 ± 5 μM y kcat/KM de 900 ± 200 M⁻¹s⁻¹, representando una aceleración de >10⁸ veces mayor que la hidrólisis no catalizada; los diseños mostraron unión de zinc con Kd entre 10⁻¹⁰ y 10⁻⁸ M, mostraron especificidad de sustrato en 4 de 5 andamios y podían reprogramarse para clivar la proteína TDP-43 humana relevante para la enfermedad con 4 variantes, logrando un ≥80% de clivagancia en 5 horas.
Autores: Hojae Choi y al Donald Hilvert, Samuel J. Pellock, David Baker
Enlace:

619
¿Puede un modelo de lenguaje aprender la estructura de ARN sin datos explícitos de entrenamiento estructural@NatureComms @Tsinghua_Uni
"ERNIE-ARN: un modelo de lenguaje de ARN con representaciones mejoradas por estructura"
• Los modelos existentes de lenguaje de ARN pasan por alto la información estructural en las secuencias, lo que conduce a una extracción incompleta de características y a un rendimiento subóptimo, a pesar de la organización jerárquica del ARN, donde las secuencias primarias se pliegan en conformaciones estructurales específicas que determinan funciones biológicas. Los enfoques computacionales tradicionales para la predicción de estructuras de ARN enfrentan desafíos distintos: los métodos basados en termodinámica están limitados por la precisión de los parámetros, los métodos basados en alineación luchan por no tener secuencias homólogas suficientes, y los modelos de aprendizaje profundo muestran una generalización limitada a familias de ARN no vistas. Aunque han surgido modelos de lenguaje de ARN tipo BERT como RNA-FM (entrenado con 23 millones de secuencias), UNI-RNA (1.000 millones de secuencias, 400M de parámetros) y RiNALMo (secuencias 36M, 650M parámetros), no incorporan adecuadamente la información estructural, y algunos como UTR-LM intentan abordar esto incorporando estructuras predichas de RNAfold, pero enfrentándose a limitaciones derivadas de errores de predicción y una menor capacidad de generalización.
• ERNIE-RNA es un modelo de lenguaje preentrenado con ARN de 86 millones de parámetros basado en arquitectura BERT modificada con 12 bloques transformadores y 12 cabezas de atención, entrenado con 20,4 millones de secuencias de ARN no codificantes de RNAcentral tras filtrar secuencias superiores a 1022 nucleótidos y aplicar la eliminación de redundancia CD-HIT con un 100% de similitud. El modelo incorpora un mecanismo de sesgo de atención informado por emparejamiento de bases que asigna valores de 2 para pares AU, 3 para pares CG y un parámetro ajustable α (inicialmente 0,8) para pares GU en una matriz de posición por pares todos contra todos, reemplazando el término de polarización en la primera capa transformadora. El preentrenamiento utilizó modelado de lenguaje enmascarado con el 15% de los tokens reemplazados aleatoriamente, entrenado durante 20 días en 24 GPUs 32G-V100 usando fairseq con tasa base de aprendizaje 0,0001, 20.000 pasos de calentamiento y decaimiento de peso 0,01, generando tanto mapas de atención (L×L×156) como embeddings de tokens (12×768×L) como salidas.
• Los mapas de atención de ERNIE-RNA demostraron capacidad de predicción de estructuras secundarias de ARN sin disparo con una puntuación mediana de F1 de 0,552 en el conjunto de pruebas bpRNA-1m, superando RNAfold (0,492), RNAstructure (0,491), RNAErnie (0,440) y RNA-BERT (0,365) sin ajustes finos. Tras un ajuste fino, ERNIE-RNA logró puntuaciones macro-medias F1 de 0,873 en bpRNA-1m, superando a RiNALMo (0,850, parámetros 650M) y UNI-RNA (0,821, parámetros 400M), con liderazgo similar en ArchiveII (0,954 frente a 0,892 de RiNALMo) y RIVAS TestSetB (0,721 frente a 0,555 de RiNALMo). En pruebas desafiantes de generalización entre familias, ERNIE-ARN congelado logró puntuaciones F1 de 0,646 en bpRNA-nuevo y 0,590 en RNA3DB-2D, superando métodos tradicionales de programación dinámica como Eternafold (0,639) y manteniendo la superioridad sobre todos los competidores en aprendizaje profundo. ERNIE-RNA también logró un rendimiento superior en diversas tareas posteriores: predicción del mapa de contacto de ARN con precisión Top-L/1 de 0,68 (frente al conjunto de RNAcontact de 0,46), predicción de MRL 5'UTR con R² de 0,92 en el conjunto de prueba aleatoria y 0,86 en el conjunto de prueba humana, predicción de unión ARN-proteína superando a todos los métodos probados, precisión de clasificación de la familia de NCRNA de 0,9844 (0% ruido de frontera) y 0,9820 (200% ruido de frontera), Puntuaciones F1 de predicción del sitio de empalme que oscilan entre 0,9180 y 0,9612 en cuatro especies, precisión top-K del 55,37% en el conjunto de datos SpliceAI (frente al 34,84% de RNA-FM), y predicción alternativa de poliadenilación R² del 78,39% (frente al 70,32% de RNA-FM).
Autores: Weijie Yin, Zhaoyu Zhang, Shuo Zhang, Liang He, etc. al Xuegong Zhang, Tao Qin y Zhen Xie
Enlace:

644
¿Puede la inteligencia artificial diseñar péptidos terapéuticos imitando cómo las proteínas naturales se unen a los objetivos de la enfermedad?@Tsinghua_Uni @natBME
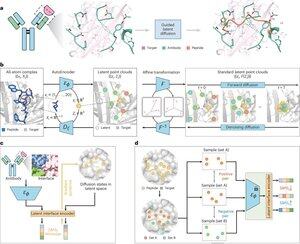
"Diseño de péptidos a través de la imitación de la interfaz de unión con PepMimic"
• Los investigadores desarrollaron PepMimic, un algoritmo de IA que combina un autocodificador de todos los átomos, un modelo de difusión latente y un codificador de interfaz para diseñar péptidos (4-25 aminoácidos) que imitan las interfaces de unión entre proteínas diana y aglutinantes conocidos como anticuerpos o receptores, abordando las limitaciones en el diseño actual de péptidos que requieren experiencia manual y luchan con superficies de unión discontinuas.
• Más de 80 terapias peptídicas están aprobadas para enfermedades como la diabetes y el cáncer, lo que ofrece ventajas como alta especificidad, menor toxicidad y posible administración oral en comparación con moléculas pequeñas y productos biológicos, sin embargo, el diseño de imitaciones peptídicas de interacciones proteína-proteína tradicionalmente requiere una amplia experiencia y no puede manejar de manera efectiva interfaces de unión discontinuas, mientras que los modelos de IA existentes se centran en enfoques de columna vertebral y luego secuencia en lugar de capturar cadenas laterales cruciales geometría para interacciones precisas de aminoácidos.
• PepMimic se entrenó en 4.157 complejos proteína-péptido y 70.645 fragmentos similares a péptidos del Banco de Datos de Proteínas, utilizando un autocodificador para mapear geometrías de todos los átomos en el espacio latente, un modelo de difusión para 100 pasos de eliminación de ruido y aprendizaje contrastivo para entrenar un codificador de interfaz que guía la generación minimizando las distancias entre las interfaces diseñadas y de referencia en el espacio latente, con candidatos clasificados utilizando la energía de interfaz de Rosetta. La energía FoldX, las métricas de aciertos de la interfaz y las puntuaciones de pLDDT del multímero AlphaFold antes de seleccionar los péptidos superiores (384 para objetivos con aglutinantes conocidos, 94-290 para aglutinantes generados por IA) para experimentos de imágenes de resonancia de plasmones de superficie.
• PepMimic logró un AUROC medio de 0,71 en 31 tareas en 93 complejos de prueba (superando el 0,69 de RFDiffusion), diseñó 384 péptidos para 5 dianas farmacológicas (PD-L1, CD38, BCMA, HER2, CD4) con un 8% logrando KD < 100 nM y 26 péptidos alcanzando KD a un nivel de 10⁻⁹ M (sustancialmente más alto que el cribado de bibliotecas aleatorias), generó péptidos que imitan los aglutinantes diseñados por IA para CD38 y TROP2 con una tasa de éxito del 14% (16% para CD38, 8% para TROP2) y demostró una selección tumoral in vivo eficaz en modelos de ratón con péptidos seleccionados que muestran una captación 8,85 veces mayor en los tumores positivos para PD-L1 y una captación 16,18 veces mayor en los tumores positivos para TROP2, logrando tasas de éxito de 20.000 a 90.000 veces más altas que el cribado experimental de bibliotecas aleatorias.
Autores: Xiangzhe Kong et. al Zihua Wang, Yang Liu y @musicsuperman
Enlace:
1.25K
Populares
Ranking
Favoritas












