熱門話題
#
Bonk 生態迷因幣展現強韌勢頭
#
有消息稱 Pump.fun 計劃 40 億估值發幣,引發市場猜測
#
Solana 新代幣發射平臺 Boop.Fun 風頭正勁

DailyHealthcareAI
分享有關人工智慧在放射學、病理學、遺傳學、蛋白質設計等領域的應用的研究論文和新聞。讓我們一起來學習吧!
🚀David Baker 來自 @UWproteindesign 的預印本 👇👇
為什麼切割蛋白質鍵如此具有挑戰性,以至於自然進化出專門的酶與金屬輔因子來完成這一任務?@biorxivpreprint @ETH_en
"半胱氨酸蛋白酶的計算設計"
• 蛋白質中的酰胺鍵在生理條件下的半衰期長達數百年,使其比酯鍵穩定得多(胺離子基團的 pKa >35,而活化酯的 pKa <8),而之前的計算酶設計僅在活化的小分子酯底物上取得成功,而無法實現蛋白酶所需的能量要求高的肽鍵切割。
• 研究人員使用 RoseTTAFold Diffusion 2 for Molecular Interfaces (RFD2-MI) 從最小催化基元設計鋅蛋白酶,構建了一個理想的活性位點,包含五個功能基團(三個鋅結合殘基 H1、H2、E1,一個催化基 E2 和一個穩定負氧離子的酪氨酸 Y),基於氨肽酶 N 和 astacin 結構,進行了蛋白酶和底物序列的雙面設計,以確保目標酰胺鍵的精確定位。
• 在單次設計回合中測試的 135 個設計中,36% 顯示出活性(鋅單一模型為 14.7%,鋅-水模型為 87.5%),所有活性設計在質譜確認的預定位置精確切割;最活躍的設計(Zn45 切割 ZnO36 底物)達到 kcat 為 0.025 ± 0.002 s⁻¹,KM 為 26 ± 5 μM,kcat/KM 為 900 ± 200 M⁻¹s⁻¹,代表著比未催化水解快超過 10⁸ 倍的速率加速;設計顯示鋅結合的 Kd 在 10⁻¹⁰ 到 10⁻⁸ M 之間,在 5 個支架中有 4 個顯示底物特異性,並且可以重新編程以切割與疾病相關的人類 TDP-43 蛋白,4 個變體在 5 小時內達到 ≥80% 的切割。
作者:Hojae Choi 等,Donald Hilvert,Samuel J. Pellock,David Baker
鏈接:

697
語言模型能否在沒有明確結構訓練數據的情況下學習RNA結構?@NatureComms @Tsinghua_Uni
"ERNIE-RNA:一種具有結構增強表示的RNA語言模型"
• 現有的RNA語言模型忽略了序列中的結構信息,導致特徵提取不完整和性能不佳,儘管RNA具有層次組織,主要序列摺疊成特定的結構構象,決定生物功能。傳統的RNA結構預測計算方法面臨著不同的挑戰:基於熱力學的方法受限於參數準確性,基於比對的方法在缺乏足夠同源序列的情況下掙扎,而深度學習模型對未見RNA家族的泛化能力有限。雖然像RNA-FM(訓練於2300萬序列)、UNI-RNA(10億序列,4億參數)和RiNALMo(3600萬序列,6.5億參數)等BERT風格的RNA語言模型已經出現,但它們未能充分納入結構信息,其中一些如UTR-LM試圖通過納入來自RNAfold的預測結構來解決此問題,但面臨預測錯誤和降低的泛化能力的限制。
• ERNIE-RNA是一個擁有8600萬參數的RNA預訓練語言模型,基於修改過的BERT架構,具有12個變壓器塊和12個注意力頭,訓練於2040萬非編碼RNA序列,來自RNAcentral,過濾掉長於1022個核苷酸的序列,並在100%相似度下應用CD-HIT冗餘去除。該模型納入了一種基於配對的注意力偏置機制,為AU對分配值2,CG對分配值3,並為GU對分配可調參數α(最初為0.8)在全對全的配對位置矩陣中,替換第一個變壓器層中的偏置項。預訓練使用了掩碼語言建模,隨機替換15%的標記,使用24個32G-V100 GPU訓練20天,使用fairseq,基礎學習率為0.0001,20000個預熱步驟,0.01的權重衰減,生成注意力圖(L×L×156)和標記嵌入(12×768×L)作為輸出。
• ERNIE-RNA的注意力圖展示了零樣本RNA二級結構預測能力,在bpRNA-1m測試集上的中位F1分數為0.552,超越了RNAfold(0.492)、RNAstructure(0.491)、RNAErnie(0.440)和RNA-BERT(0.365),無需微調。經過微調後,ERNIE-RNA在bpRNA-1m上達到了0.873的最新宏平均F1分數,超越了RiNALMo(0.850,6.5億參數)和UNI-RNA(0.821,4億參數),在ArchiveII(0.954對RiNALMo的0.892)和RIVAS TestSetB(0.721對RiNALMo的0.555)上也保持了類似的領先地位。在具有挑戰性的跨家族泛化測試中,ERNIE-RNA frozen在bpRNA-new上達到了0.646的F1分數,在RNA3DB-2D上達到了0.590,超越了傳統的動態編程方法如Eternafold(0.639),並在所有深度學習競爭者中保持優勢。ERNIE-RNA在各種下游任務中也表現出色:RNA接觸圖預測的Top-L/1精度為0.68(對比RNAcontact的集成0.46),5'UTR MRL預測在隨機測試集上的R²為0.92,在人類測試集上的R²為0.86,RNA-蛋白質結合預測超越了所有測試方法,ncRNA家族分類準確率為0.9844(0%邊界噪聲)和0.9820(200%邊界噪聲),剪接位點預測F1分數在四個物種之間範圍為0.9180到0.9612,SpliceAI數據集的top-K準確率為55.37%(對比RNA-FM的34.84%),替代聚腺苷酸化預測的R²為78.39%(對比RNA-FM的70.32%)。
作者:Weijie Yin, Zhaoyu Zhang, Shuo Zhang, Liang He等,Xuegong Zhang, Tao Qin & Zhen Xie
鏈接:

728
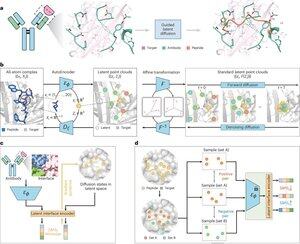
人工智慧能否透過模仿天然蛋白質與疾病靶點的結合方式來設計治療性肽?@Tsinghua_Uni @natBME
"透過結合介面模仿進行肽設計的 PepMimic"
• 研究人員開發了 PepMimic,這是一種 AI 演算法,結合了全原子自編碼器、潛在擴散模型和介面編碼器,以設計模仿靶蛋白與已知結合物(如抗體或受體)之間結合介面的肽(4-25 個氨基酸),解決了當前肽設計中需要手動專業知識且難以處理不連續結合表面的限制。
• 超過 80 種肽治療劑已獲得批准,用於包括糖尿病和癌症在內的疾病,提供了高特異性、低毒性和潛在口服給藥等優勢,相較於小分子和生物製劑,然而,傳統上設計蛋白質-蛋白質相互作用的肽模擬物需要廣泛的專業知識,且無法有效處理不連續的結合介面,而現有的 AI 模型則專注於骨架然後序列的方法,而不是捕捉關鍵的側鏈幾何形狀以準確地進行氨基酸相互作用。
• PepMimic 在 4,157 個蛋白質-肽複合物和來自蛋白質數據庫的 70,645 個肽類片段上進行訓練,使用自編碼器將全原子幾何映射到潛在空間,擴散模型進行 100 次去噪步驟,並通過對比學習訓練介面編碼器,通過最小化設計和參考介面在潛在空間中的距離來指導生成,候選者使用 Rosetta 介面能量、FoldX 能量、介面命中指標和 AlphaFold Multimer pLDDT 分數進行排名,然後選擇前肽(384 個針對已知結合物的靶點,94-290 個針對 AI 生成的結合物)進行表面等離子共振成像實驗。
• PepMimic 在 93 個測試複合物的 31 個任務中達到平均 AUROC 0.71(超過 RFDiffusion 的 0.69),為 5 個藥物靶點(PD-L1、CD38、BCMA、HER2、CD4)設計了 384 個肽,其中 8% 的肽達到 KD < 100 nM,26 個肽達到 10⁻⁹ M 水平的 KD(顯著高於隨機文庫篩選),生成模仿 AI 設計結合物的 CD38 和 TROP2 的肽,成功率為 14%(CD38 為 16%,TROP2 為 8%),並在小鼠模型中展示了有效的體內腫瘤靶向,選定的肽在 PD-L1 陽性腫瘤中的攝取量提高了 8.85 倍,在 TROP2 陽性腫瘤中的攝取量提高了 16.18 倍,成功率比實驗隨機文庫篩選高出 20,000-90,000 倍。
作者:Xiangzhe Kong 等,Zihua Wang,Yang Liu 和 @musicsuperman
鏈接:
1.31K
熱門
排行
收藏












