Актуальные темы
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
Обмен научными работами и новостями о применении искусственного интеллекта в радиологии, патологии, генетике, дизайне белков и многом другом. Давайте учиться вместе!
🚀Предварительная публикация Дэвида Бейкера из @UWproteindesign 👇👇
Что делает разрыв белковых связей таким сложным, что природа эволюционировала специализированные ферменты с металлическими кофакторами для его осуществления?@biorxivpreprint @ETH_en
"Компьютерный дизайн цистеиновых протеаз"
• Амидные связи в белках имеют период полураспада в сотни лет при физиологических условиях, что делает их гораздо более стабильными, чем эфирные связи (с аминогруппами, имеющими pKa >35 против <8 для активированных эфиров), и предыдущий компьютерный дизайн ферментов был успешен только с активированными субстратами маломолекулярных эфиров, а не с энергетически затратным разрывом пептидных связей, необходимым для протеаз.
• Исследователи использовали RoseTTAFold Diffusion 2 для молекулярных интерфейсов (RFD2-MI) для проектирования цинковых протеаз из минимальных каталитических мотивов, создавая идеальный активный сайт с пятью функциональными группами (три остатка, связывающих цинк H1, H2, E1, одна каталитическая база E2 и один стабилизирующий оксианион тирозин Y) на основе структур аминопептидазы N и астацин, выполняя двусторонний дизайн как последовательностей протеазы, так и субстрата для обеспечения точного позиционирования целевой амидной связи.
• Из 135 дизайнов, протестированных в одном раунде проектирования, 36% показали активность (14.7% для моделей только с Zn и 87.5% для моделей Zn-вода), при этом все активные дизайны разрывали точно в запланированных местах, что было подтверждено масс-спектрометрией; самый активный дизайн (Zn45, разрывающий субстрат ZnO36) достиг kcat 0.025 ± 0.002 s⁻¹, KM 26 ± 5 μM и kcat/KM 900 ± 200 M⁻¹s⁻¹, что представляет собой >10⁸-кратное ускорение скорости по сравнению с некатализируемым гидролизом; дизайны демонстрировали связывание цинка с Kd между 10⁻¹⁰ и 10⁻⁸ M, показали специфичность к субстрату в 4 из 5 каркасов и могли быть перепрограммированы для разрыва относящегося к болезни человеческого белка TDP-43 с 4 вариантами, достигнувшими ≥80% разрыва за 5 часов.
Авторы: Ходжэ Чой и др. Дональд Хилверт, Самуэль Дж. Пеллок, Дэвид Бейкер
Ссылка:

617
Может ли языковая модель изучить структуру РНК без явных данных о структурном обучении?@NatureComms @Tsinghua_Uni
"ERNIE-RNA: языковая модель РНК с улучшенными представлениями структуры"
• Существующие языковые модели РНК игнорируют структурную информацию в последовательностях, что приводит к неполной экстракции признаков и субоптимальной производительности, несмотря на иерархическую организацию РНК, где первичные последовательности сворачиваются в специфические структурные конформации, определяющие биологические функции. Традиционные вычислительные подходы к предсказанию структуры РНК сталкиваются с различными проблемами: методы, основанные на термодинамике, ограничены точностью параметров, методы, основанные на выравнивании, испытывают трудности без достаточного количества гомологичных последовательностей, а модели глубокого обучения показывают ограниченную обобщаемость для невидимых семейств РНК. Хотя языковые модели РНК в стиле BERT, такие как RNA-FM (обученная на 23 миллионах последовательностей), UNI-RNA (1 миллиард последовательностей, 400 миллионов параметров) и RiNALMo (36 миллионов последовательностей, 650 миллионов параметров), появились, они не могут адекватно учитывать структурную информацию, некоторые, такие как UTR-LM, пытаются решить эту проблему, включая предсказанные структуры из RNAfold, но сталкиваются с ограничениями из-за ошибок предсказания и сниженной способности к обобщению.
• ERNIE-RNA — это языковая модель РНК с 86 миллионами параметров, предварительно обученная на основе модифицированной архитектуры BERT с 12 трансформерными блоками и 12 головами внимания, обученная на 20,4 миллионах некодирующих последовательностей РНК из RNAcentral после фильтрации последовательностей длиной более 1022 нуклеотидов и применения удаления избыточности CD-HIT при 100% сходстве. Модель включает механизм внимания, информированный о парном связывании, который присваивает значения 2 для пар AU, 3 для пар CG и настраиваемый параметр α (изначально 0.8) для пар GU в матрице парного позиционного взаимодействия, заменяя смещение в первом слое трансформера. Предварительное обучение использовало маскированное языковое моделирование с 15% токенов, случайно замененных, обучаясь в течение 20 дней на 24 32G-V100 GPU с использованием fairseq с базовой скоростью обучения 0.0001, 20 000 шагов разогрева и 0.01 уменьшением веса, генерируя как карты внимания (L×L×156), так и встраивания токенов (12×768×L) в качестве выходных данных.
• Карты внимания ERNIE-RNA продемонстрировали способность предсказания вторичной структуры РНК без обучения с медианным F1-оценкой 0.552 на тестовом наборе bpRNA-1m, превосходя RNAfold (0.492), RNAstructure (0.491), RNAErnie (0.440) и RNA-BERT (0.365) без дообучения. После дообучения ERNIE-RNA достигла передовых макро-средних F1-оценок 0.873 на bpRNA-1m, превзойдя RiNALMo (0.850, 650 миллионов параметров) и UNI-RNA (0.821, 400 миллионов параметров), с аналогичным лидерством на ArchiveII (0.954 против 0.892 RiNALMo) и RIVAS TestSetB (0.721 против 0.555 RiNALMo). На сложных тестах обобщения между семействами ERNIE-RNA frozen достигла F1-оценок 0.646 на bpRNA-new и 0.590 на RNA3DB-2D, превосходя традиционные методы динамического программирования, такие как Eternafold (0.639), и сохраняя превосходство над всеми конкурентами глубокого обучения. ERNIE-RNA также показала превосходные результаты в различных задачах: предсказание карты контактов РНК с точностью Top-L/1 0.68 (против ансамбля RNAcontact на 0.46), предсказание MRL 5'UTR с R² 0.92 на случайном тестовом наборе и 0.86 на тестовом наборе для человека, предсказание связывания РНК-белок, превосходя все протестированные методы, точности классификации семейств ncRNA 0.9844 (0% шум на границе) и 0.9820 (200% шум на границе), F1-оценки предсказания сайтов сплайсинга в диапазоне от 0.9180 до 0.9612 для четырех видов, точность top-K 55.37% на наборе данных SpliceAI (против 34.84% RNA-FM) и предсказание альтернативной полиаденилирования с R² 78.39% (против 70.32% RNA-FM).
Авторы: Вэйцзе Инь, Чжаоюй Чжан, Шуо Чжан, Лян Хэ и др. Сюэгун Чжан, Тао Цинь и Чжэнь Си
Ссылка:

642
Может ли искусственный интеллект разрабатывать терапевтические пептиды, имитируя то, как натуральные белки связываются с мишенями заболеваний?@Tsinghua_Uni @natBME
"Проектирование пептидов через имитацию интерфейсов связывания с PepMimic"
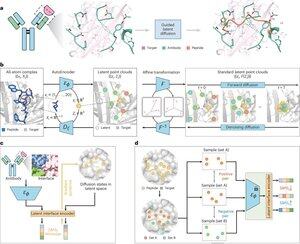
• Исследователи разработали PepMimic, алгоритм ИИ, который сочетает автоэнкодер с полными атомами, модель латентной диффузии и кодировщик интерфейса для проектирования пептидов (4-25 аминокислот), которые имитируют интерфейсы связывания между целевыми белками и известными связывающими молекулами, такими как антитела или рецепторы, решая ограничения текущего проектирования пептидов, которое требует ручной экспертизы и сталкивается с трудностями при работе с дискретными поверхностями связывания.
• Более 80 терапевтических пептидов одобрены для лечения заболеваний, включая диабет и рак, предлагая такие преимущества, как высокая специфичность, низкая токсичность и потенциальное пероральное применение по сравнению с малыми молекулами и биологическими препаратами, однако проектирование пептидных мимиков белково-белковых взаимодействий традиционно требует обширной экспертизы и не может эффективно справляться с дискретными интерфейсами связывания, в то время как существующие модели ИИ сосредоточены на подходах "сначала каркас, затем последовательность", а не на захвате важной геометрии боковых цепей для точных взаимодействий аминокислот.
• PepMimic был обучен на 4,157 комплексах белок-пептид и 70,645 фрагментах, похожих на пептиды, из Protein Data Bank, используя автоэнкодер для отображения геометрий с полными атомами в латентное пространство, модель диффузии для 100 шагов денойзинга и контрастное обучение для обучения кодировщика интерфейса, который направляет генерацию, минимизируя расстояния между спроектированными и эталонными интерфейсами в латентном пространстве, при этом кандидаты ранжируются с использованием энергии интерфейса Rosetta, энергии FoldX, метрик попадания интерфейса и оценок pLDDT AlphaFold Multimer перед выбором лучших пептидов (384 для мишеней с известными связывающими молекулами, 94-290 для сгенерированных ИИ связывающих молекул) для экспериментов по визуализации поверхностного плазмонного резонанса.
• PepMimic достиг среднего AUROC 0.71 по 31 задаче на 93 тестовых комплексах (превосходя RFDiffusion с 0.69), спроектировал 384 пептида для 5 лекарственных мишеней (PD-L1, CD38, BCMA, HER2, CD4), из которых 8% достигли KD < 100 нМ и 26 пептидов достигли уровня KD 10⁻⁹ М (значительно выше, чем при случайном скрининге библиотеки), сгенерировал пептиды, имитирующие связывающие молекулы, спроектированные ИИ для CD38 и TROP2 с 14% уровнем успеха (16% для CD38, 8% для TROP2) и продемонстрировал эффективное in vivo таргетирование опухолей в мышиных моделях, при этом выбранные пептиды показали 8.85-кратное увеличение поглощения в опухолях, положительных по PD-L1, и 16.18-кратное увеличение поглощения в опухолях, положительных по TROP2, достигая уровней успеха в 20,000-90,000 раз выше, чем при экспериментальном случайном скрининге библиотеки.
Авторы: Сянчжэ Конг и др. Цзихуа Ван, Ян Лю и @musicsuperman
Ссылка:
1,25K
Топ
Рейтинг
Избранное












