Актуальні теми
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
Обмін науковими роботами та новинами про застосування штучного інтелекту в радіології, патології, генетиці, дизайні білків та багатьох інших. Давайте вчитися разом!
🚀Препринт Девіда Бейкера з @UWproteindesign 👇👇
Що робить розрізання білкових зв'язків настільки складним, що природа еволюціонувала спеціалізовані ферменти з металевими кофакторами для цього?@biorxivpreprint @ETH_en
"Обчислювальне проєктування протеаз цистеїну"
• Амідні зв'язки в білках мають період напіврозпаду сотні років за фізіологічних умов, що робить їх значно стабільнішими, ніж ефірні зв'язки (при цьому амінові групи мають pKa >35 проти <8 у активованих ефірів), і попередня комп'ютерна розробка ферментів була успішною лише з активованими субстратами з малих молекул ефірів, а не з енергетично вимогливим розщепленням пептидних зв'язків, необхідним для протеаз.
• Дослідники використали RoseTTAFold Diffusion 2 для молекулярних інтерфейсів (RFD2-MI) для розробки цинкових протеаз з мінімальних каталізаторних мотивів, створивши ідеальний активний сайт із п'ятьма функціональними групами (три цинкові залишки H1, H2, E1, одна каталізувальна основа E2 та одна оксіаніон-стабілізуючий тирозин Y) на основі структур амінопептидази N та астацину, виконуючи двостороннє проєктування послідовностей протеази та субстрату для забезпечення точного позиціонування цільового амідного зв'язку.
• З 135 конструкцій, протестованих у одному раунді, 36% показали активність (14,7% для моделей лише з Zn і 87,5% для моделей з цинковою водою), при цьому всі активні конструкції розщеплювалися точно на задуманих місцях, підтверджених мас-спектрометрією; найактивніша конструкція (Zn45, що розщеплює підкладку ZnO36) досягла kcat 0,025 ± 0,002 с⁻¹, KM 26 ± 5 мкм та kcat/KM 900 ± 200 M⁻¹s⁻¹, що представляє прискорення у >10⁸ разів при некаталізованому гідролізі; конструкції мали зв'язування цинку з Kd між 10⁻¹⁰ і 10⁻⁸ M, демонстрували специфічність субстрату у 4 з 5 каркасів і могли бути перепрограмовані для розщеплення людського білка TDP-43, релевантного до хвороби, з 4 варіантами, що досягали ≥80% розщеплення за 5 годин.
Автори: Ходже Чхве та ал Дональд Гілверт, Семюел Дж. Пеллок, Девід Бейкер
Посилання:

612
Чи може мовна модель вивчати структуру РНК без явних структурних навчальних даних?@NatureComms @Tsinghua_Uni
"ERNIE-RNA: модель мови РНК із структурно-посиленими представленнями"
• Існуючі моделі мови РНК ігнорують структурну інформацію в послідовностях, що призводить до неповного виділення ознак і неоптимальної продуктивності, незважаючи на ієрархічну організацію РНК, де первинні послідовності складаються у специфічні структурні конформації, що визначають біологічні функції. Традиційні обчислювальні підходи до прогнозування структури РНК стикаються з чіткими викликами: методи, засновані на термодинаміці, обмежені точністю параметрів, методи, засновані на вирівнюваннях, мають труднощі без достатньої кількості гомологічних послідовностей, а моделі глибокого навчання демонструють обмежене узагальнення на невидимі сімейства РНК. Хоча з'явилися моделі мов РНК у стилі BERT, такі як RNA-FM (навчені на 23 мільйонах послідовностей), UNI-RNA (1 мільярд послідовностей, 400 млн параметрів) та RiNALMo (36 млн послідовностей, 650 млн параметрів), вони не здатні належним чином врахувати структурну інформацію, і деякі, як UTR-LM, намагаються вирішити це, включаючи прогнозовані структури з RNAfold, але стикаються з обмеженнями через помилки прогнозування та знижену здатність до узагальнення.
• ERNIE-RNA — це попередньо навчена мовна модель РНК з 86 мільйонами параметрів, заснована на модифікованій архітектурі BERT з 12 трансформерними блоками та 12 головками уваги, навчена на 20,4 мільйонах некодуючих РНК-послідовностей з RNAcentral після фільтрації послідовностей довше 1022 нуклеотидів і застосування CD-HIT резервного видалення при 100% схожості. Модель включає механізм зсуву уваги, орієнтований на базові пари, який присвоює значення 2 для пар AU, 3 для пар CG та налаштовуваний параметр α (спочатку 0,8) для пар GU у матриці позицій «усі проти всіх», замінюючи член зміщення на першому шарі трансформатора. Попереднє навчання використовувало масковане мовне моделювання з випадковим чином заміненим 15% токенів, навченим протягом 20 днів на 24 GPU 32G-V100 з використанням fairseq з базовою швидкістю навчання 0.0001, 20 000 кроків розігріву та зменшенням ваги 0.01, генеруючи як карти уваги (L×L×156), так і вкладення токенів (12×768×L) як виходи.
• Карти уваги ERNIE-RNA продемонстрували можливість прогнозування вторинної структури РНК з нульовим ударом із медіаною F1-балом 0,552 на тестовому наборі bpRNA-1m, що перевершило RNAfold (0,492), структуру RNArnie (0,491), RNAErnie (0,440) та RNA-BERT (0,365) без тонкого налаштування. Після тонкого налаштування ERNIE-RNA досягла найсучасніших макросередніх F1-балів 0,873 на bpRNA-1m, перевершивши RiNALMo (0,850, 650 млн параметрів) та UNI-RNA (0,821, 400 млн параметрів), з подібним лідерством у ArchiveII (0,954 проти 0,892 у RiNALMo) та RIVAS TestSetB (0,721 проти 0,555 у RiNALMo). У складних тестах узагальнення між сім'ями ERNIE-RNA frozen отримав F1-бали 0,646 на bpRNA-new і 0,590 на RNA3DB-2D, перевершивши традиційні методи динамічного програмування, такі як Eternafold (0,639), і зберігаючи перевагу над усіма конкурентами у глибокому навчанні. ERNIE-RNA також досягла відмінних результатів у різних наступних завданнях: прогнозування карти контактів РНК з точністю Top-L/1 0,68 (проти ансамблю RNAcontact при 0,46), прогнозування MRL 5'UTR з R² 0,92 на випадковому тестовому наборі та 0,86 на людському тестовому наборі, прогнозування зв'язування РНК-білка, що перевершило всі тестовані методи, точність класифікації сімейств ncRNA 0,9844 (0% шум на межі) та 0,9820 (200% шум на межі), прогнозування місця зрощення F1 коливаються від 0,9180 до 0,9612 у чотирьох видах, точність топ-K 55,37% за набором даних SpliceAI (проти 34,84% у RNA-FM) та альтернативне прогнозування поліаденілювання R² 78,39% (проти 70,32% у RNA-FM).
Автори: Вейцзе Інь, Чжаоюй Чжан, Шуо Чжан, Лян Хе та ін. аль Сюегун Чжан, Тао Цінь і Чжень Сє
Посилання:

637
Чи може штучний інтелект розробляти терапевтичні пептиди, імітуючи те, як природні білки зв'язуються з мішенями захворювання?@Tsinghua_Uni @natBME
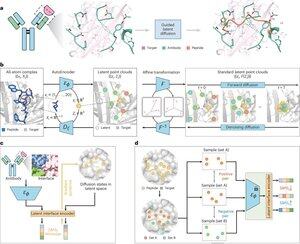
"Пептидний дизайн за допомогою імітації інтерфейсу зв'язування з PepMimic"
• Дослідники розробили PepMimic, алгоритм штучного інтелекту, який поєднує автоенкодер з усіма атомами, модель латентної дифузії та кодувальник інтерфейсу для проектування пептидів (4-25 амінокислот), які імітують інтерфейси зв'язування між цільовими білками та відомими зв'язувальними речовинами, такими як антитіла або рецептори, усуваючи обмеження в поточному дизайні пептидів, який вимагає ручного досвіду та бореться з переривчастими поверхнями зв'язування.
• Понад 80 пептидних терапевтичних засобів схвалені для лікування захворювань, включаючи діабет і рак, пропонуючи такі переваги, як висока специфічність, нижча токсичність і потенційне пероральне введення в порівнянні з малими молекулами і біологічними препаратами, але розробка пептидних імітацій білково-білкових взаємодій традиційно вимагає великого досвіду і не може ефективно обробляти інтерфейси переривчастого зв'язування, в той час як існуючі моделі штучного інтелекту зосереджені на підходах «магістраль-потім-послідовність», а не на захопленні важливого бічного ланцюга. геометрія для точної взаємодії амінокислот.
• PepMimic був навчений на 4 157 білково-пептидних комплексах і 70 645 пептидних фрагментах з Protein Data Bank, використовуючи автокодер для відображення геометрії всіх атомів у латентний простір, дифузійну модель для 100 ступенів знешумлення та контрастне навчання для навчання кодувальника інтерфейсу, який керує генерацією, мінімізуючи відстані між розробленими та еталонними інтерфейсами в латентному просторі, з кандидатами, ранжованими за допомогою енергії інтерфейсу Rosetta, Енергія FoldX, показники влучень інтерфейсу та бали AlphaFold Multimer pLDDT перед вибором найкращих пептидів (384 для мішеней з відомими сполучними речовинами, 94-290 для сполучних, згенерованих штучним інтелектом) для експериментів з поверхневого плазмонного резонансного резонансу.
• PepMimic досягла середнього AUROC 0,71 у 31 завданні на 93 тестових комплексах (перевершуючи 0,69 RFDiffusion), розробила 384 пептиди для 5 мішеней ліків (PD-L1, CD38, BCMA, HER2, CD4) з 8% досягнувши KD < 100 нМ і 26 пептидів досягла KD на рівні 10⁻⁹ M (значно вище, ніж скринінг випадкової бібліотеки), згенерувала пептиди, що імітують сполучні речовини, розроблені штучним інтелектом, для CD38 і TROP2 з 14% успіхом (16% для CD38, 8% для TROP2) і продемонстрував ефективність націлювання на пухлини in vivo на мишачих моделях з вибраними пептидами, які показали у 8,85 разів більше поглинання в PD-L1-позитивних пухлинах і в 16,18 разів більше захоплення в TROP2-позитивних пухлинах, досягнувши показників успіху в 20 000-90 000 разів вище, ніж при експериментальному випадковому бібліотечному скринінгу.
Автори: Сянчже Конг та ін. Аль Цзіхуа Ван, Ян Лю та @musicsuperman
Посилання:
1,25K
Найкращі
Рейтинг
Вибране












