Populaire onderwerpen
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
Het delen van onderzoekspapers en nieuws over AI-toepassingen in radiologie, pathologie, genetica, eiwitontwerp en nog veel meer. Laten we samen leren!
🚀David Baker preprint van @UWproteindesign 👇👇
Wat maakt het zo uitdagend om eiwitbindingen te knippen, dat de natuur gespecialiseerde enzymen met metaalcofactoren heeft ontwikkeld om dit te bereiken?@biorxivpreprint @ETH_en
"Computational design van cysteïne proteasen"
• Amidebindingen in eiwitten hebben een halveringstijd van honderden jaren onder fysiologische omstandigheden, waardoor ze veel stabieler zijn dan esterbindingen (met amine verlatingsgroepen met pKa >35 versus <8 voor geactiveerde esters), en eerdere computationele enzymontwerpen zijn alleen geslaagd met geactiveerde kleine molecuulester-substraten in plaats van de energetisch veeleisende peptidebindingknip die vereist is voor proteasen.
• De onderzoekers gebruikten RoseTTAFold Diffusion 2 voor Moleculaire Interfaces (RFD2-MI) om zinkproteasen te ontwerpen vanuit minimale katalytische motieven, waarbij een ideaal actieve site werd geconstrueerd met vijf functionele groepen (drie zinkbindende residuen H1, H2, E1, één katalytische base E2, en één oxyanion-stabiliserende tyrosine Y) gebaseerd op aminopeptidase N en astacinestructuren, en voerden een tweezijdig ontwerp uit van zowel protease- als substraatsequenties om een nauwkeurige positionering van de doelamidebinding te waarborgen.
• Van de 135 ontwerpen die in één ontwerpronde werden getest, toonde 36% activiteit (14,7% voor alleen Zn-modellen en 87,5% voor Zn-water modellen), waarbij alle actieve ontwerpen precies op de bedoelde locaties knipten, bevestigd door massaspectrometrie; het meest actieve ontwerp (Zn45 dat ZnO36-substraat knipt) bereikte een kcat van 0,025 ± 0,002 s⁻¹, KM van 26 ± 5 μM, en kcat/KM van 900 ± 200 M⁻¹s⁻¹, wat >10⁸-voudige versnelling van de snelheid vertegenwoordigt ten opzichte van ongekatalyseerde hydrolyse; ontwerpen vertoonden zinkbinding met Kd tussen 10⁻¹⁰ en 10⁻⁸ M, toonden substraatspecificiteit in 4 van de 5 schimmels, en konden opnieuw worden geprogrammeerd om de ziekte-relevante menselijke TDP-43-eiwit te knippen met 4 varianten die ≥80% knipten na 5 uur.
Auteurs: Hojae Choi et. al Donald Hilvert, Samuel J. Pellock, David Baker
Link:

616
Kan een taalmodel de RNA-structuur leren zonder expliciete structurele trainingsdata?@NatureComms @Tsinghua_Uni
"ERNIE-RNA: een RNA-taalmodel met structuurversterkte representaties"
• Bestaande RNA-taalmodellen negeren structurele informatie in sequenties, wat leidt tot onvolledige feature-extractie en suboptimale prestaties, ondanks de hiërarchische organisatie van RNA waarbij primaire sequenties zich vouwen in specifieke structurele conformaties die biologische functies bepalen. Traditionele computationele benaderingen voor RNA-structuurvoorspelling staan voor verschillende uitdagingen: thermodynamica-gebaseerde methoden zijn beperkt door parameter nauwkeurigheid, alignement-gebaseerde methoden hebben moeite zonder voldoende homologe sequenties, en deep learning-modellen tonen beperkte generalisatie naar ongeziene RNA-families. Terwijl BERT-stijl RNA-taalmodellen zoals RNA-FM (getraind op 23 miljoen sequenties), UNI-RNA (1 miljard sequenties, 400M parameters) en RiNALMo (36M sequenties, 650M parameters) zijn opgekomen, slagen ze er niet in om structurele informatie adequaat te integreren, waarbij sommige zoals UTR-LM proberen dit aan te pakken door voorspelde structuren van RNAfold op te nemen, maar tegen beperkingen aanlopen door voorspellingsfouten en verminderde generalisatiecapaciteit.
• ERNIE-RNA is een RNA voorgetraind taalmodel met 86 miljoen parameters, gebaseerd op een gemodificeerde BERT-architectuur met 12 transformerblokken en 12 aandachtshoofden, getraind op 20,4 miljoen niet-coderende RNA-sequenties van RNAcentral na filtering van sequenties langer dan 1022 nucleotiden en het toepassen van CD-HIT-redundantie verwijdering bij 100% gelijkenis. Het model bevat een base-pairing-geïnformeerd aandacht-biasmechanisme dat waarden van 2 toekent voor AU-paren, 3 voor CG-paren, en een instelbare parameter α (aanvankelijk 0.8) voor GU-paren in een all-against-all pair-wise positie matrix, waarbij de bias-term in de eerste transformerlaag wordt vervangen. Voortraining gebruikte gemaskeerde taalmodellering met 15% van de tokens willekeurig vervangen, getraind gedurende 20 dagen op 24 32G-V100 GPU's met fairseq met een basis leersnelheid van 0.0001, 20.000 opwarmstappen en 0.01 gewichtsafname, wat zowel aandachtkaarten (L×L×156) als token-embeddings (12×768×L) als output genereerde.
• De aandachtkaarten van ERNIE-RNA toonden een zero-shot RNA secundaire structuurvoorspellingscapaciteit met een mediaan F1-score van 0.552 op de bpRNA-1m testset, wat beter presteert dan RNAfold (0.492), RNAstructure (0.491), RNAErnie (0.440) en RNA-BERT (0.365) zonder fine-tuning. Na fine-tuning bereikte ERNIE-RNA state-of-the-art macro-gemiddelde F1-scores van 0.873 op bpRNA-1m, wat RiNALMo (0.850, 650M parameters) en UNI-RNA (0.821, 400M parameters) overtrof, met vergelijkbare leiding op ArchiveII (0.954 vs RiNALMo's 0.892) en RIVAS TestSetB (0.721 vs RiNALMo's 0.555). Bij uitdagende cross-familie generalisatietests behaalde ERNIE-RNA frozen F1-scores van 0.646 op bpRNA-new en 0.590 op RNA3DB-2D, wat beter presteert dan traditionele dynamische programmeermethoden zoals Eternafold (0.639) en de superioriteit behoudt ten opzichte van alle deep learning concurrenten. ERNIE-RNA behaalde ook superieure prestaties op diverse downstream-taken: RNA contactmapvoorspelling met Top-L/1 precisie van 0.68 (vs RNAcontact's ensemble op 0.46), 5'UTR MRL-voorspelling met R² van 0.92 op willekeurige testset en 0.86 op menselijke testset, RNA-eiwitbindingvoorspelling die alle geteste methoden overtreft, ncRNA-familieclassificatie nauwkeurigheden van 0.9844 (0% grensruis) en 0.9820 (200% grensruis), splice site voorspelling F1-scores variërend van 0.9180 tot 0.9612 over vier soorten, top-K nauwkeurigheid van 55.37% op de SpliceAI dataset (vs RNA-FM's 34.84%), en alternatieve polyadenylering voorspelling R² van 78.39% (vs RNA-FM's 70.32%).
Auteurs: Weijie Yin, Zhaoyu Zhang, Shuo Zhang, Liang He et. al Xuegong Zhang, Tao Qin & Zhen Xie
Link:

641
Kan kunstmatige intelligentie therapeutische peptiden ontwerpen door na te bootsen hoe natuurlijke eiwitten binden aan ziekte-doelen?@Tsinghua_Uni @natBME
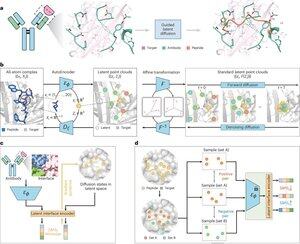
"Peptide-ontwerp door nabootsing van bindingsinterfaces met PepMimic"
• Onderzoekers hebben PepMimic ontwikkeld, een AI-algoritme dat een all-atom autoencoder, latent diffusie model en interface encoder combineert om peptiden (4-25 aminozuren) te ontwerpen die bindingsinterfaces nabootsen tussen doel-eiwitten en bekende binders zoals antilichamen of receptoren, waarmee beperkingen in het huidige peptide-ontwerp worden aangepakt dat handmatige expertise vereist en moeite heeft met discontinuïteitsbindingsoppervlakken.
• Meer dan 80 peptide-therapeutica zijn goedgekeurd voor ziekten zoals diabetes en kanker, met voordelen zoals hoge specificiteit, lagere toxiciteit en potentiële orale toediening in vergelijking met kleine moleculen en biologics, maar het ontwerpen van peptide-nabootsingen van eiwit-eiwit interacties vereist traditioneel uitgebreide expertise en kan discontinuïteitsbindingsinterfaces niet effectief aan, terwijl bestaande AI-modellen zich richten op backbone-then-sequence benaderingen in plaats van cruciale side-chain geometrie vast te leggen voor nauwkeurige aminozuurinteracties.
• PepMimic is getraind op 4.157 eiwit-peptide complexen en 70.645 peptide-achtige fragmenten uit de Protein Data Bank, met behulp van een autoencoder om all-atom geometrieën naar latente ruimte te mappen, een diffusie model voor 100 denoising stappen, en contrastieve leren om een interface encoder te trainen die generatie begeleidt door afstanden tussen ontworpen en referentie-interfaces in latente ruimte te minimaliseren, met kandidaten gerangschikt op basis van Rosetta interface-energie, FoldX-energie, interface hit-metrics en AlphaFold Multimer pLDDT-scores voordat de beste peptiden (384 voor doelen met bekende binders, 94-290 voor AI-gegenereerde binders) worden geselecteerd voor oppervlakte plasmon resonantie beeldvormingsexperimenten.
• PepMimic behaalde een gemiddelde AUROC van 0,71 over 31 taken op 93 testcomplexen (beter dan RFDiffusion's 0,69), ontwierp 384 peptiden voor 5 geneesmiddeldoelen (PD-L1, CD38, BCMA, HER2, CD4) met 8% die KD < 100 nM bereikten en 26 peptiden die KD op 10⁻⁹ M-niveau bereikten (substantieel hoger dan willekeurige bibliotheek screening), genereerde peptiden die AI-ontworpen binders voor CD38 en TROP2 nabootsten met een succespercentage van 14% (16% voor CD38, 8% voor TROP2), en toonde effectieve in vivo tumor targeting in muismodellen met geselecteerde peptiden die 8,85-voudig hogere opname in PD-L1-positieve tumoren en 16,18-voudig hogere opname in TROP2-positieve tumoren vertoonden, met succespercentages 20.000-90.000 keer hoger dan experimentele willekeurige bibliotheek screening.
Auteurs: Xiangzhe Kong et. al Zihua Wang, Yang Liu & @musicsuperman
Link:
1,25K
Boven
Positie
Favorieten












