トレンドトピック
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.

DailyHealthcareAI
放射線学、病理学、遺伝学、タンパク質設計などにおけるAIアプリケーションに関する研究論文やニュースを共有します。一緒に学びましょう!
🚀デイビッド・ベイカー @UWproteindesign👇👇からのプレプリント
なぜタンパク質結合を切断することがこれほど難しいのでしょうか?自然界では金属補因子を持つ特殊な酵素が進化したのでしょうか@biorxivpreprint @ETH_en
「システインプロテアーゼの計算設計」
• タンパク質中のアミド結合は生理学的条件下で数百年の半減期を持ち、エステル結合よりもはるかに安定しています(アミン離脱基はpKa>35、活性化エステルは<8)。これまでの計算酵素設計は、プロテアーゼに必要なエネルギー的に要求の高いペプチド結合切断ではなく、活性化された小分子エステル基質でのみ成功しています。
• 研究者たちはRoseTTAFold Diffusion 2 for Molecular Interfaces(RFD2-MI)を用いて、最小限の触媒モチーフから亜鉛プロテアーゼを設計し、アミノペプチダーゼNおよびアスタシン構造に基づく5つの官能基(3つの亜鉛結合残基H1、H2、E1、1個触媒塩基E2、1つのオキシアニオン安定化チロシンY)を用いた理想的な活性部位を構築し、ターゲットアミド結合の正確な位置を確保するためにプロテアーゼおよび基質配列の両側設計を行いました。
• 135設計が単一設計ラウンドで試験され、36%が活性を示しました(Zn単独モデル14.7%、Zn水モデル87.5%)、すべてのアクティブ設計は質量分析で意図された部位で正確に切断されていました。最も活発な設計(Zn45をZnO36基板切断)では、kcatは0.025±0.002 s⁻¹、KMは26 ± 5 μM、kcat/KMは900 ± 200 M⁻¹⁻¹であり、非触媒加水分解に対する>10/1倍の加速率を示しました。設計はKdとの10⁻¹⁰から10⁻⁸ Mの亜鉛結合を示し、5つの足場のうち4つで基質特異性を示し、4つの変異体を持つ疾患関連ヒトTDP-43タンパク質を切断するために再プログラム可能で、5時間で≥80%の切断を達成しました。
著者:チェ・ホジェ ほかアル・ドナルド・ヒルバート、サミュエル・J・ペロック、デイヴィッド・ベイカー
リンク:

694
言語モデルは明示的な構造訓練データなしでRNA構造を学習できるのでしょうか@NatureComms @Tsinghua_Uni
「ERNIE-RNA:構造強化表現を持つRNA言語モデル」
• 既存のRNA言語モデルは配列内の構造情報を見落としており、その結果、RNAは一次配列が生物的機能を決定する特定の構造的構造に折りたたまれているにもかかわらず、特徴抽出が不完全で最適でないパフォーマンスを生み出しています。従来のRNA構造予測の計算手法は明確な課題に直面しています。熱力学に基づく手法はパラメータ精度に制約され、アラインメントベースの手法は十分な相同配列がなければ苦戦し、深層学習モデルは見えないRNAファミリーへの一般化が限られています。RNA-FM(2300万配列で訓練)、UNI-RNA(10億配列、4億パラメータ)、RiNALMo(3600万配列、6億500万パラメータ)などのBERTスタイルRNA言語モデルが登場しましたが、構造情報を十分に組み込めていなかったものもあり、UTR-LMのようにRNAfoldからの予測構造を取り入れて解決しようと試みるものもありますが、予測誤差や一般化能力の低下という制約に直面しています。
• ERNIE-RNAは、修正されたBERTアーキテクチャに基づく8600万パラメータのRNA事前学習言語モデルで、12のトランスフォーマーブロックと12の注意ヘッドを持ち、1022個を超える配列をフィルタリングし、CD-HIT冗長除去を100%類似度で適用した後、RNAcentralの2040万個の非コードRNA配列で訓練されています。このモデルは、全対全のペア対位置行列で調整可能なパラメータα(当初は0.8)を割り当てる塩基対対応の注意バイアス機構を組み込んでおり、AUペアには2、CGペアに対して3、GUペアに対してはパラメータ(当初は0.8)を割り当て、最初のトランス層のバイアス項を置き換えています。事前学習ではマスク言語モデリングを用い、トークンの15%をランダムに置き換え、24台の32G-V100 GPUで20日間、fairseqを用いてベース学習率0.0001で訓練し、20,000回のウォームアップステップと0.01のウェイト減衰を行い、注意マップ(L×L×156)とトークン埋め込み(12×768×L)を出力として生成しました。
• ERNIE-RNAの注意マップは、bpRNA-1mテストセットで中央値F1スコア0.552のゼロショットRNA二次構造予測能力を示し、微調整なしでRNAフォールド(0.492)、RNA構造(0.491)、RNAErnie(0.440)、RNA-BERT(0.365)を上回る成績を示しました。微調整の結果、ERNIE-RNAはbpRNA-1mで最先端のマクロ平均F1スコア0.873を達成し、RiNALMo(0.850、650Mパラメータ)やUNI-RNA(0.821、400Mパラメータ)を上回り、ArchiveII(0.954、RiNALMoの0.892)やRIVAS TestSetB(0.721、RiNALMoの0.555)でも同様のリーダーシップを発揮しました。難しいファミリー間一般化検定において、ERNIE-RNAフローズンはbpRNA-newで0.646、RNA3DB-2Dで0.590のF1スコアを獲得し、Eternafoldのような従来の動的プログラミング手法(0.639)を上回り、すべてのディープラーニング競合他社に対して優位性を維持しました。ERNIE-RNAは多様な下流タスクでも優れた性能を達成しました。Top-L/1の精度0.68(RNAcontactのアンサンブル0.46に対し)、5'UTR MRL予測(ランダムテストセットでR²0.92、ヒトテストセットで0.86)、RNA-タンパク質結合予測がすべてのテスト手法を上回る性能、ncRNAファミリー分類精度0.9844(境界ノイズ0%)および0.9820(境界ノイズ200%)、 スプライスサイト予測のF1スコアは4種で0.9180から0.9612の範囲で、SpliceAIデータセットでのトップK精度は55.37%(RNA-FMの34.84%)、代替ポリアデニル化予測R²は78.39%(RNA-FMの70.32%)です。
著者:尹偉傑、張趙玉、張朔、梁和ら。アル・シュエゴン・チャン、陶欽、ジェン・シエ
リンク:

697
人工知能は、天然タンパク質が疾患標的に結合する方法を模倣して治療用ペプチドを設計できるでしょうか@Tsinghua_Uni @natBME
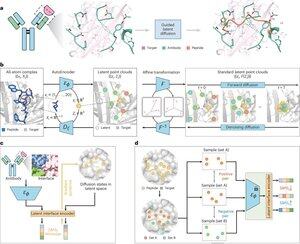
「PepMimicによる結合界面模倣によるペプチド設計」
• 研究者らは、全原子オートエンコーダー、潜在拡散モデル、およびインターフェースエンコーダーを組み合わせたAIアルゴリズムであるPepMimicを開発し、標的タンパク質と抗体や受容体などの既知の結合剤との間の結合界面を模倣するペプチド(4〜25アミノ酸)を設計し、手作業の専門知識を必要とし、不連続な結合面に苦労している現在のペプチド設計の限界に対処しました。
• 糖尿病やがんなどの疾患に対して80以上のペプチド治療薬が承認されており、低分子や生物製剤と比較して高い特異性、低い毒性、経口投与の可能性などの利点がありますが、タンパク質間相互作用のペプチド模倣物の設計には従来、広範な専門知識が必要であり、不連続な結合界面を効果的に処理することはできませんが、既存のAIモデルは重要な側鎖を捕捉するのではなく、バックボーンと配列のアプローチに焦点を当てています正確なアミノ酸相互作用のための形状
• PepMimicは、タンパク質データバンクからの4,157個のタンパク質-ペプチド複合体と70,645個のペプチド様フラグメントでトレーニングされ、オートエンコーダーを使用して全原子形状を潜在空間にマッピングし、100ステップの拡散モデル、および対照学習を使用して、潜在空間で設計されたインターフェースと参照インターフェースの間の距離を最小化することで生成をガイドするインターフェースエンコーダーをトレーニングし、候補はRosettaインターフェースエネルギーを使用してランク付けされました。 表面プラズモン共鳴画像法実験用に上位ペプチド(既知のバインダーを含むターゲットの場合は384、AI生成バインダーの場合は94〜290)を選択する前に、FoldXエネルギー、界面ヒットメトリック、およびAlphaFoldマルチマーpLDDTスコア。
• PepMimicは、93のテスト複合体の31タスクで平均AUROC0.71を達成し(RFDiffusionの0.69を上回り)、5つの薬物標的(PD-L1、CD38、BCMA、HER2、CD4)に対して384のペプチドを設計し、8%が100 nMのKD<達成し、26のペプチドが10⁻⁹ MレベルでKDに達しました(ランダムライブラリスクリーニングよりも大幅に高い)、AIが設計したCD38およびTROP2のバインダーを模倣したペプチドを14%の成功率で生成しました(CD38、 TROP2については8%)、選択されたペプチドを使用したマウスモデルで効果的なin vivo腫瘍ターゲティングが実証され、PD-L1陽性腫瘍で8.85倍、TROP2陽性腫瘍で16.18倍高い取り込みを示し、実験的ランダムライブラリスクリーニングの20,000〜90,000倍高い成功率を達成しました。
著者: Xiangzhe Kong et.アル・ジワ・ワン、ヤン・リウ&@musicsuperman
リンク:
1.3K
トップ
ランキング
お気に入り












